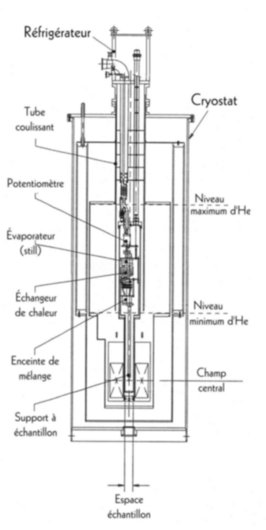
Pouvez-vous nous expliquer le fonctionnement du nouveau
réfrigérateur à dilution?
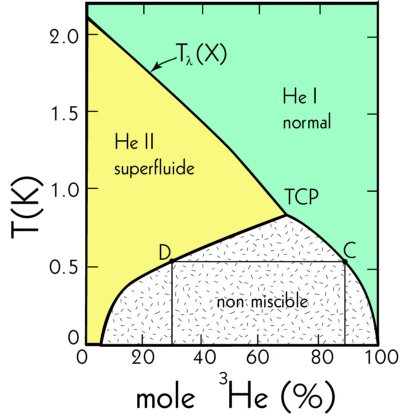
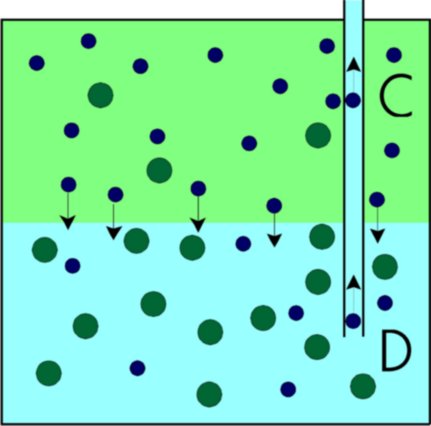
En premier lieu, examinons le fonctionnement d’un réfrigérateur à l’hélium liquide. Pour abaisser la température de ce liquide cryogénique, il suffit de pomper la vapeur d’hélium dans le cryostat. Pour comprendre ce phénomène, rappelons qu’à la surface de tout liquide, les deux phases (liquide et vapeur) sont en équilibre, c’est-à-dire, qu’il y a autant d’atomes du liquide qui s’évaporent que d’atomes du gaz qui se liquéfient. En diminuant la pression du gaz d’hélium, l’équilibre est rompu et une partie des atomes du liquide à la surface utiliseront la chaleur du liquide pour s’évaporer. Un nouvel équilibre s’installera, mais à plus basse température. Par analogie, nous expérimentons ce phénomène chaque fois qu’une partie humide de notre corps est exposée à l’air. Pour s’évaporer l’eau utilise la chaleur locale pour se transformer en vapeur et nous éprouvons alors une sensation de froid.
-p.jpg)
Théoriquement, il est possible d’atteindre de très basses
températures en abaissant la pression, cependant ce moyen est limité techniquement.